Ads Cardiovascular
METALYSE
Estás aquí
Contáctanos
Solución
El frasco ámpula con polvo liofilizado contiene:
|
Tenecteplasa 50 mg (10000 U) Excipiente cs |
Tenecteplasa 40 mg (8000 U) Excipiente cs |
|
La jeringa con diluyente contiene: Agua estéril 10 mL Para uso inyectable |
La jeringa con diluyente contiene: Agua estéril 8 mL Para uso inyectable |
Activador de plasminógeno tisular de Origen ADN recombinante expresado en células de ovario de hámster chino (CHO)
La solución reconstituida contiene 1,000 unidades (5 mg) de tenecteplasa por mL.
La potencia de tenecteplasa se expresa en unidades (U) usando un estándar de referencia que es específico para tenecteplasa y no es comparable con las unidades utilizadas para otros agentes trombolíticos.
Metalyse® está indicado en el tratamiento trombolítico del infarto agudo al miocardio (IAM). El tratamiento debe ser iniciado tan pronto sea posible después del inicio de los síntomas.
La terapia trombolítica se asocia con riesgo de hemorragia. Metalyse® está contraindicado en las siguientes situaciones:
- trastorno hemorrágico significativo actual o dentro de los últimos seis meses, diátesis hemorrágica conocida
- pacientes que reciban tratamiento con anticoagulante oral concomitante efectivo, por ej,: warfarina sódica (cociente internacional normalizado INR >1,3) (referirse a la sección de Precauciones, subsección “Sangrado”)
- antecedentes de lesión del sistema nervioso central (ej., neoplasma, aneurisma, cirugía intracraneal o espinal)
- hipertensión grave, no controlada
- cirugía mayor, biopsia de un órgano parenquimatoso o traumatismo significativo en los últimos dos meses (incluye cualquier traumatismo asociado con el IAM actual), traumatismo craneoencefálico reciente
- reanimación cardiopulmonar prolongada o traumática (> 2 minutos) dentro de las dos últimas semanas
- disfunción hepática grave, incluidas insuficiencia hepática, cirrosis, hipertensión portal (várices esofágicas) y hepatitis activa
- úlcera péptica activa
- aneurisma arterial y malformación arterial/venosa conocida
- neoplasma con aumento del riesgo de hemorragia
- pericarditis aguda y/o endocarditis bacteriana subaguda
- pancreatitis aguda
- accidente cerebrovascular hemorrágico o de origen desconocido en cualquier momento
- accidente cerebrovascular isquémico o accidente isquémico transitorio (AIT) en los últimos seis meses.
Así como con otros agentes trombolíticos, la hemorragia es el efecto más común no deseable asociado con el uso de Metalyse®. Se puede producir hemorragia en cualquier sitio o cavidad corporal, y puede provocar situaciones potencialmente fatales, discapacidad permanente o muerte.
El tipo de hemorragia (sangrado) asociado con terapia trombolítica puede ser dividida en dos grandes categorías:
- Sangrado superficial, normalmente en sitios de inyección
- Sangrados internos en cualquier sitio o cavidad corporal. Los síntomas neurológicos como somnolencia, afasia, hemiparesia y convulsiones pueden estar asociados a hemorragia intracraneal
Trastornos del Sistema Inmune
Reacciones anafilactoides (rash, urticaria, broncoespasmo, edema laríngeo, angioedema).
Trastornos del sistema nervioso
Hemorragia intracraneal (como hemorragia cerebral, hematoma cerebral, accidente cerebro vascular hemorrágico, transformación hemorrágica del accidente cerebro vascular, hematoma intracraneal, hemorragia subaracnoidea).
Trastornos oculares
Hemorragia ocular.
Trastornos cardiacos
Arritmias de reperfusión (asistolia, arritmia idioventricular acelerada, arritmia, extrasístoles, fibrilación auricular, bloqueo auriculoventricular de primer grado, bloqueo auriculoventricular completo, bradicardia, taquicardia, arritmia ventricular, fibrilación ventricular, taquicardia ventricular) ocurren en una muy cercana relación temporal bajo tratamiento con Metalyse®. Las arritmias de reperfusión pueden producir un paro cardiaco, que comprometa la vida y puede requerir el uso de terapias antiarrítmicas convencionales.
Hemorragia pericárdica.
Trastornos vasculares
Hemorragia.
Embolismo.
Trastornos respiratorios, torácicos, y mediastinales
Epistaxis.
Hemorragia pulmonar.
Trastornos gastrointestinales
Hemorragia gastrointestinal (hemorragia gástrica, úlcera gástrica y hemorragia, hemorragia rectal, hematemesis, melena, hemorragia bucal), náuseas, vómitos.
Hemorragia retroperitoneal (como hematoma retroperitoneal)
Trastornos de piel y tejido celular subcutáneo
Equimosis.
Trastornos Renales y Urinarios
Hemorragia urogenital (como hematuria, hemorragia del tracto urinario).
Trastornos generales y condiciones del sitio de administración
Hemorragia en el sitio de inyección, hemorragia en el sitio de punción.
Exploraciones complementarias
Disminución de la presión arterial
Incremento de la temperatura corporal.
Lesiones traumáticas, envenenamiento y complicaciones del procedimiento
Embolismo graso que puede tener consecuencias en los órganos afectados.
Procedimientos médicos y quirúrgicos
Transfusión.
FRECUENCIA DE REACCIONES ADVERSAS
Tabla 1. Categorías de frecuencias:
|
Muy frecuentes |
≥1/10 |
|
Frecuentes |
≥1/100 – <1/10 |
|
Poco frecuentes |
≥1/1000 – <1/100 |
|
Raros |
≥1/10000 – <1/1000 |
|
Muy raros |
<1/10000 |
|
Desconocidos |
no pueden estimarse a partir de los datos disponibles |
Tabla 2. Frecuencias de las Reacciones adversas
|
MedDRA Clasificación por sistema y órgano |
Reacción adversa de tenecteplasa según terminología de la CCDS |
Categorías de frecuencia según la Guía SmPC de la UE |
|
Trastornos del sistema inmunológico |
Reacción anafilactoide - exantema - urticaria - broncoespasmo - edema laríngeo |
Raros |
|
Trastornos del sistema nervioso |
Hemorragia intracraneal - hemorragia cerebral - hematoma cerebral - accidente cerebrovascular hemorrágico - transformación hemorrágica de accidente cerebrovascular - hematoma intracraneal - hemorragia subaracnoidea |
Poco frecuentes |
|
Trastornos oculares |
Hemorragia ocular |
Poco frecuentes |
|
Trastornos cardíacos |
Arritmias de reperfusión - asistolia - arritmia idioventricular acelerada |
Poco frecuentes |
|
- arritmia - extrasístoles - fibrilación auricular - bloqueo auriculoventricular de primer grado - bloqueo auriculoventricular completo - bradicardia - taquicardia - arritmia ventricular - fibrilación ventricular - taquicardia ventricular |
||
|
Hemorragia del pericardio |
Raros |
|
|
Trastornos vasculares |
Hemorragia |
Muy frecuentes |
|
Embolia |
Raros |
|
|
Trastornos respiratorios, torácicos y mediastínicos |
Epistaxis |
Frecuentes |
|
Hemorragia pulmonar |
Raros |
|
|
Trastornos gastrointestinales |
Hemorragia gastrointestinal - hemorragia gástrica - hemorragia de úlcera gástrica - hemorragia rectal - hematemesis - melena - hemorragia bucal |
Frecuentes |
|
Náuseas |
Desconocidos |
|
|
vómitos |
Desconocidos |
|
|
Hemorragia retroperitoneal - hematoma retroperitoneal |
Poco frecuentes |
|
|
Trastornos de la piel y del tejido subcutáneo |
Equimosis |
Frecuentes |
|
Trastornos renales y urinarios |
Hemorragia urogenital - hematuria - hemorragia de las vías urinarias |
Frecuentes |
|
Trastornos generales y afecciones del sitio de administración |
Hemorragia en el lugar de la inyección, hemorragia en el sitio de la punción |
Frecuentes |
|
Exploraciones complementarias |
descenso de la presión arterial |
Raros |
|
aumento de la temperatura corporal |
Desconocidos |
|
|
Lesiones, intoxicaciones y complicaciones del procedimiento |
embolia grasa |
Desconocidos |
Vía de administración: Intravenosa.
Este medicamento deberá ser administrado mediante inyección en bolo intravenoso.
Metalyse® debe ser administrado en base al peso corporal, con un máximo de dosificación de 10,000 UI (50 mg de tenecteplasa). El volumen requerido para administrar la dosis correcta puede ser calculado en base al siguiente esquema:
|
Categoría de |
Tenecteplasa |
Tenecteplasa |
Volumen |
|
< 60 |
6,000 |
30 |
6 |
|
≥ 60 a < 70 |
7,000 |
35 |
7 |
|
≥ 70 a < 80 |
8,000 |
40 |
8 |
|
≥ 80 a < 90 |
9,000 |
45 |
9 |
|
≥ 90 |
10,000 |
50 |
10 |
Terapia concomitante:
La terapia antitrombótica adjunta se recomienda de acuerdo a las guías internacionales actuales para el manejo de pacientes con infarto agudo de miocardio con elevación del segmento ST.
Para información sobre la intervención coronaria, véase la sección de Precauciones Generales.
Método de Administración
La solución reconstituida debe administrarse por vía intravenosa y utilizarse inmediatamente después de su reconstitución.
La dosis requerida debe ser administrada en bolo intravenoso único en un lapso de aproximadamente 5-10 segundos.
INSTRUCCIONES DE USO
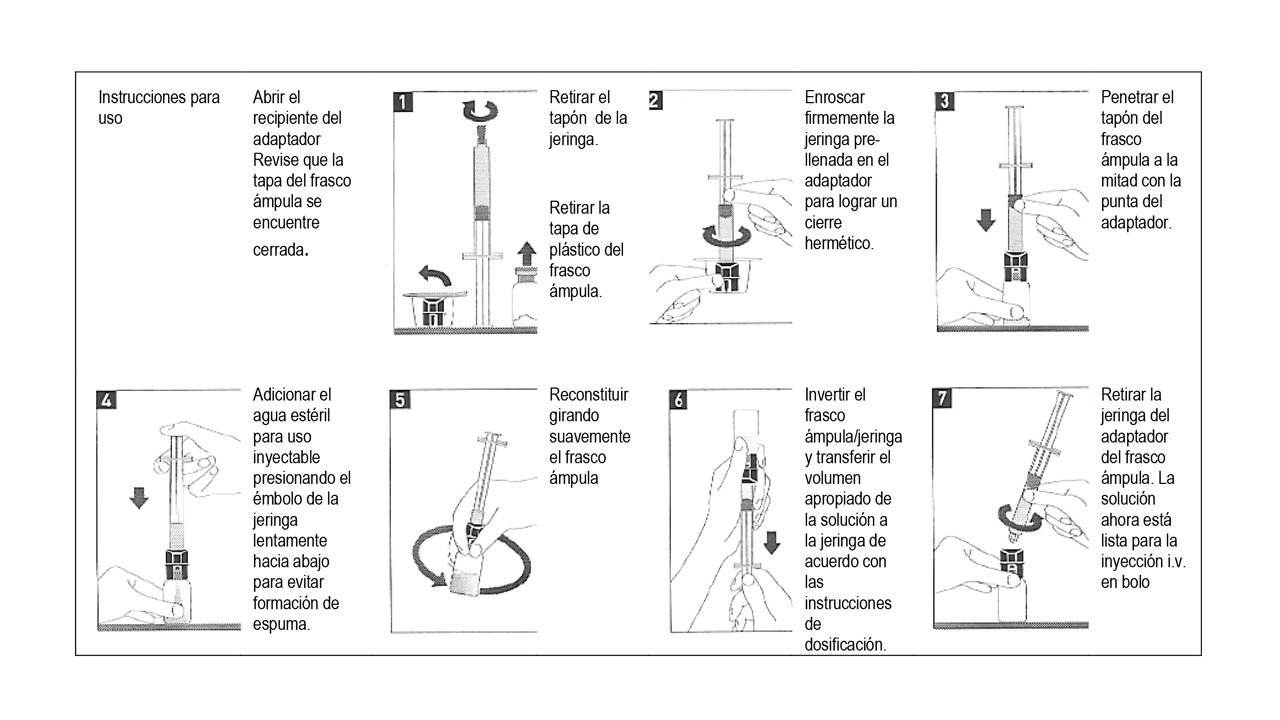
Metalyse® debe ser reconstituido añadiendo el volumen completo de agua estéril para uso inyectablede la jeringa precargada al frasco ámpula conteniendo el polvo para la inyección.
- El volumen requerido para administrar la dosis correcta se puede calcular a partir de la tabla (Vea dosis y administración, Categoría de peso corporal de pacientes).
- Revise que la tapa del frasco ámpula esté aún intacta.
- Retire la tapa del frasco ámpula.
- Retire la tapa de la jeringa. Luego atornille inmediatamente la jeringa pre-llenada en el adaptador del frasco y penetre el tapón del frasco en el centro con el punto del adaptador del mismo.
- Agregue el agua estéril para uso inyectable al frasco ámpula empujando el émbolo de la jeringa lentamente hacia abajo para evitar hacer espuma.
- Reconstituir girándolo suavemente.
- La preparación reconstituida es una solución transparente entre incolora y amarillo pálido. Solo se debe administrar una solución sin partículas.
- Inmediatamente antes de la administración de la solución, invierta el frasco ámpula con la jeringa aún ligada, de tal manera que la jeringa está debajo del frasco ámpula.
- Saque el volumen apropiado de solución reconstituida de Metalyse® a la jeringa, basado en el peso del paciente.Desconecte la jeringa del frasco ámpula.
- Desconecte la jeringa del frasco ámpula.
- Metalyse® puede utilizarse una vía intravenosa preexistente, que solamente se haya utilizado para la administración de solución de cloruro de sodio al 0.9 %. Metalyse® no se debe mezclar con otros fármacos, ni en el mismo vial de infusión ni en la misma vía venosa (ni siquiera con heparina).
- Metalyse® debe ser administrado al paciente por vía intravenosa en aproximadamente 5 a 10 segundos. No debe ser administrado a la vía conteniendo dextrosa.
- Se debe hacer un lavado de la vía después de la inyección de Metalyse para una correcta administración.
- Toda solución no utilizada debe descartarse.



