Ads Cardiovascular
ACTILYSE
Estás aquí
Contáctanos
|
Solución |
|
|
El frasco ámpula con polvo liofilizado contiene: Activador de |
50 mg |
|
El frasco ámpula con diluyente contiene: |
50 mL |
La solución reconstituida contiene 1 mg de alteplasa por mL
Tratamiento trombolítico del infarto agudo al miocardio (IAM):
-
Régimen de tratamiento acelerado de 90 minutos, en los pacientes para los cuales el tratamiento puede comenzar dentro de las primeras 6 horas del inicio de la sintomatología, y
-
Régimen de tratamiento de 3 horas, para los pacientes en los que el tratamiento puede comenzar entre 6 - 12 horas después del inicio de los síntomas.
El diagnóstico debe ser confirmado en la medida de lo posible con elementos diagnósticos certeros como la angiografía pulmonar o procedimientos no invasivos como la gammagrafía pulmonar de ventilación/perfusión.
El tratamiento debe comenzar tan temprano como sea posible dentro de las 4.5 horas del inicio de los síntomas de EVC y después de excluir la hemorragia intracraneal mediante técnicas de imagen adecuadas (p. ej., tomografía axial computarizada (TAC) de cráneo u otros métodos de imagen diagnósticos sensibles para detectar la presencia de hemorragia). El efecto del tratamiento es tiempo-dependiente, por lo tanto, tratamientos más tempranos incrementan la probabilidad de un resultado favorable.
- Pacientes con hipersensibilidad conocida al principio activo alteplasa, o a cualquiera de los excipientes.
- Embarazo, lactancia y menores de 18 años.
- Trastorno hemorrágico significativo actual o durante los últimos 6 meses, diátesis hemorrágica conocida.
- Pacientes en tratamiento efectivo con anticoagulantes orales, p. ej., warfarina sódica (INR >1.3) (Ver Precauciones Generales, subsección “Sangrado”).
- Antecedentes de daño al sistema nervioso central (p. ej., neoplasia, aneurisma, cirugía intracraneal o de la médula espinal).
- Antecedente, evidencia o sospecha de hemorragia intracraneal incluyendo, la hemorragia subaracnoidea.
- Hemorragia severa o grave, manifiesta o reciente.
- Resucitación cardiopulmonar prolongada o traumática (>2 minutos), en el transcurso de los últimos 10 días.
- Parto dentro de los últimos 10 días.
- Punción reciente de un vaso sanguíneo no comprimible (por ej. vena subclavia o yugular).
- Hipertensión arterial severa no controlada.
- Endocarditis bacteriana, pericarditis.
- Pancreatitis aguda.
- Enfermedad gastrointestinal ulcerosa documentada durante los últimos 3 meses.
- Enfermedad hepática severa, incluidas insuficiencia hepática, cirrosis, hipertensión portal (várices esofágicas) y hepatitis activa.
- Cirugía mayor o traumatismo importante en los últimos 10 días (incluido cualquier traumatismo asociado con el infarto agudo de miocardio actual).
- Traumatismo reciente de cabeza o de cráneo.
- Aneurismas arteriales, malformaciones venosas/arteriales.
- Neoplasia con mayor riesgo de sangrado.
- Antecedentes de EVC hemorrágico o EVC de origen desconocido.
- EVC isquémico o ataques isquémicos transitorios (AIT) dentro de los 6 meses previos, excepto EVC tipo isquémico agudo actual producido dentro de las últimas 4.5 horas.
- Antecedentes de EVC hemorrágico o EVC de origen desconocido.
- EVC isquémico o ataques isquémicos transitorios (AIT) dentro de los 6 meses previos, excepto EVC tipo isquémico agudo actual producido dentro de las últimas 4.5 horas.
- Síntomas de EVC isquémico que comenzaron más de 4.5 horas antes del inicio de la infusión o desconocimiento del momento de inicio de los síntomas.
- Síntomas de EVC isquémico agudo que fueron leves o mejoraron rápidamente antes del inicio de la infusión.
- EVC severo según la evaluación clínica (p. ej., NIHSS > 25) y/o por estudios de diagnóstico por imágenes adecuados.
- Convulsiones al inicio del EVC.
- Antecedentes de EVC previo o traumatismo de cabeza serio en los últimos 3 meses.
- Combinación de EVC y diabetes mellitus.
- Administración de heparina dentro de las 48 horas previas al inicio del EVC con tiempo de tromboplastina parcial activada (TTPa/KPTT) elevado en la presentación.
- Recuento de plaquetas inferior a 100,000/mm3.
- Presión arterial sistólica >185 mmHg o presión arterial diastólica >110 mmHg, o necesidad de manejo agresivo (medicación IV) para reducir la presión arterial a estos límites.
- Glucemia <50 mg/dL o >400 mg/dL (<2.8 mmol/L o >22.2 mmol/L).
- Sangrado superficial, normalmente de los sitios de venopunción o en vasos sanguíneos lesionados.
- Hemorragia interna, en cualquier sitio o cavidad corporal.
| Muy frecuente |
≥ 1/10 |
≥ 10% |
| Frecuente |
≥ 1/100 - < 1/10 |
≥ 1% < 10% |
| Poco frecuente |
≥ 1/1000 - < 1/100 |
≥ 0.1 % < 1% |
| Rara |
≥ 1/10,000 - < 1/1000 |
≥ 0.01 % < 0.01 % |
| Muy rara | < 1/10,000 | < 0.01 % |
| Frecuencia desconocida | No se puede estimar a partir de los datos disponibles | |
Tabla 1: Reacciones adversas enumeradas en la CCDS y frecuencias correspondientes según la Guía de SmPC de la UE (basado en ASSENT II)
|
Reacciones adversas - indicaciones de infarto agudo de miocardio, embolia pulmonar
masiva aguda y accidente cerebrovascular isquémico agudo
|
| Clasificación por sistema y órgano Terminología del MedDRA |
Reacciones adversas [a la alteplasa] según término textual de la CCDS, TP del MedDRA
(versión 24.1)
|
Frecuencias según la Guía de SPC de la UE |
| Trastornos del sistema inmunitario |
Reacciones anafilactoides
Pueden presentarse como:
- exantema
- urticaria
- broncoespasmo
- angioedema
- hipotensión
- shock o cualquier otro síntoma asociado con hipersensibilidad
|
Rara |
| Trastornos oculares | hemorragia ocular | rara |
| Trastornos cardiacos | hemorragia pericárdica | rara |
| Trastornos vasculares | hemorragia como hematoma | muy frecuente (17,1 %) |
| Emboliaa | rara | |
| sangrado de órganos parenquimatosos, como hemorragia hepáticab | frecuencia desconocidab | |
| Trastornos respiratorios, torácicos y mediastínicos | hemorragia del aparato respiraorio como: | |
| hemorragia faríngea | frecuente | |
| hemoptisis | poco frecuente | |
| epistaxis | poco frecuente | |
| hemorragia pulmonar | rara | |
| Trastornos gastrointestinales | hemorragia gastrointestinal, como hemorragia gástrica, hemorragia de úlcera gástrica, hemorragia rectal, hematemesis, melena, hemorragia bucal, sangrado gingival | frecuente |
| hemorragia retroperitoneal, como hematoma retroperitoneal | rara | |
| náuseas | rara | |
| vómitosb | frecuencia desconocidab | |
| Trastornos de la piel y del tejido subcutáneo | equimosis | frecuente |
| Trastornos renales y urinarios | hemorragia urogenital, como hematuria, hemorragia del aparato urinario | frecuente |
| Trastornos generales y afecciones del lugar de la administración | hemorragia en el lugar de la inyección, hemorragia en el lugar de la punción, como hemorragia en el sitio de inserción del catéter | frecuente |
| Exproraciones complementarias | disminución de la presión arterial | poco frecuente |
| aumento en la temperatura corporalb | frecuencia desconocidab | |
| Lesiones e intoxicaciones | Embolia grasab | frecuencia desconocidab |
| Procedimientos médicos y quirúrgicos | transfusiónb | frecuencia desconocidab |
b = BI determinó la frecuencia de estas reacciones adversas sobre la base de los datos que surgen del estudio clínico (ASSENT II).
Tabla 2: Reacciones adversas enumeradas en la CCDS y frecuencias correspondientes según la Guía de SmPC de la UE (basado en ASSENT II)
|
Reacciones adversas - Indicaciones de infarto agudo al miocardio |
| Clasificación por sistema y órgano Terminología del medDRA | Reacciones adversas [a la alteplasa] según término textual de la CCDS, TP del MedDRA (versión 24.1) |
Frecuencias según
la Guía de SPC de la UE
|
| Trastornos del sistema nervioso | hemorragia intracreaneal (LLT), como hemorragia cerebral, hematoma cerebral, ACV hemorrágico, transformación hemorrágica de ACV, hematoma intracraneal, hemorragia subaracnoidea | frecuente |
| Trastornos cardiacos | arritmias por reprefusióna, como arritmia, extrasístoles, fibrilación auricular, bloqueo auriculoventricular completo, bradicardia, taquicardia, arritmia ventricular, fibrilación ventricular, taquicardia ventricular. | poco frecuente |
Tabla 3: Reacciones adversas de HIC enumeradas en la CCDS y frecuencias correspondientes según la Guía de SmPC de la UE (basado en ASSENT II)
| Reacciones adversas - Indicación embolia pulmonar masiva aguda |
| Clasificación por sistema y órgano Terminología del MedDRA | Reacciones adversas [a la alteplasa] según término textual de la CCDS, TP del MedDRA (versión 24.1) |
Frecuencias según la
Guía de SPC de la UE
|
| Trastornos del sistema nervioso |
hemorragia intracraneal (LLT), como hemorragia cerebral, hematoma cerebral, ACV hemorrágico, transformación hemorrágica de ACV, hematoma intracraneal, hemorragia subaracnoidea
|
frecuente |
Tabla 4: Reacciones adversas de HIC enumeradas en la CCDS y frecuencias correspondientes según la Guía de SmPC de la UE (basado en NINDS A+B y ECASS III)
| Reacciones adversas - Indicación eventocerebrovascular isquémico agudo |
| Clasificación por sistema y órgano Terminología del MedDRA | Reacciones adversas [a la alteplasa] según término textual de la CCDS, TP del MedDRA (versión 24.1) |
Frecuencias según la
Guía de SPC de la UE
|
| Trastornos del sistema nervioso | hemorragia intracraneal (LLT), como hemorragia cerebral, hematoma cerebral, ACV hemorrágico, transformación hemorrágica de ACV, hematoma intracraneal, hemorragia subaracnoidea | frecuente |
Caja de cartón con:
- 2 frascos ámpula con 50 mg de polvo liofilizado cada uno.
- 2 frascos ámpula con 50 mL de diluyente cada uno.
- 1 cánula de conducción de plástico.
- 1 instructivo anexo.
Actilyse® deberá administrarse a la brevedad posible una vez iniciada la sintomatología.
Vía de administración: Intravenosa.
La administración de este medicamento por vía intravenosa deberá realizarse en bolo seguido de infusión.
La solución reconstituida debe administrarse por vía intravenosa y utilizarse de inmediato.
Este producto es de muy alto riesgo, solo deberá ser administrado por médicos especialistas. Uso exclusivamente intrahospitalario.
Infarto agudo de miocardio
a) Régimen de infusión acelerada de 90 minutos
Para los pacientes con infarto agudo del miocardio en los cuales el tratamiento puede iniciarse dentro de 6 horas subsiguientes al inicio de los síntomas:
En pacientes con un peso corporal ≥ 65 kg:
- 15 mg como bolo intravenoso, seguidos inmediatamente de 50 mg como infusión intravenosa durante los primeros 30 minutos, seguida de una infusión intravenosa de 35 mg durante 60 minutos, hasta la dosis máxima de 100 mg.
En pacientes con un peso corporal ≤65 kg, la dosis total debe ajustarse en función del peso a
- 15 mg como bolo intravenoso, seguido inmediatamente de 0.75 mg/kg de peso corporal como infusión intravenosa durante los primeros 30 minutos (máximo 50 mg), seguido de una infusión intravenosa de 0.5 mg/kg durante 60 minutos (hasta un máximo de 35 mg).
b) Régimen de infusión de 3 horas para los pacientes con infarto agudo de miocardio en los cuales el tratamiento puede iniciarse dentro de las 6 a 12 horas subsiguientes al inicio de los síntomas.
En pacientes con un peso corporal ≥ 65 kg:
- 10 mg como bolo intravenoso, seguidos inmediatamente de 50 mg como infusión intravenosa durante la primera hora, seguida de una infusión intravenosa de 40 mg durante las dos horas siguientes, hasta alcanzar la dosis máxima de 100 mg.
En pacientes con un peso corporal < 65 kg:
- 10 mg como bolo intravenoso, seguidos inmediatamente de una infusión intravenosa a velocidad constante durante 3 horas hasta alcanzar una dosis total máxima de 1.5 mg/kg de peso corporal.
La dosis máxima aceptada para Actilyse® es de 100mg.
Tratamiento coadyuvante:
El tratamiento trombolítico coadyuvante se recomienda de acuerdo a las guías internacionales actuales para el manejo de pacientes con infarto agudo del miocardio con elevación del segmento ST.
Tromboembolia pulmonar masiva aguda
En pacientes con un peso corporal ≥ 65 kg:
Debe de administrarse una dosis total de 100 mg en 2 horas. La mayor experiencia disponible corresponde al siguiente régimen posológico:
- 10 mg como bolo intravenoso durante 1 - 2 minutos, seguido inmediatamente de 90 mg como infusión intravenosa durante 2 horas hasta alcanzar la dosis total de 100 mg
En pacientes con un peso corporal < 65 kg:
- 10 mg como bolo intravenoso durante 1 – 2 minutos, seguido inmediatamente de una infusión intravenosa a velocidad constante durante 2 horas hasta alcanzar una dosis total máxima de 1.5 mg/kg de peso corporal.
Tratamiento coadyuvante:
Después de iniciado el tratamiento con Actilyse® se debe iniciar la administración de heparina, una vez que los valores del TPTa sean menores a dos veces el límite máximo normal. La infusión debe ajustarse de manera de mantener los valores del TPTa entre 50 - 70 segundos (1.5 a 2.5 veces el valor de referencia).
Evento cerebro vascular isquémico agudo
La dosis total recomendada de Actilyse® es de 0.9 mg/kg de peso corporal (dosis máxima 90 mg). Se debe comenzar con el 10% del total de la dosis en forma de bolo intravenoso inicial, seguida inmediatamente del resto de la dosis total administrada por infusión intravenosa durante 60 minutos.
El tratamiento debe iniciarse a la mayor brevedad posible dentro de las 4.5 horas de iniciados los síntomas, véase la sección Precauciones generales. El efecto del tratamiento depende del tiempo, por lo tanto cuanto antes se inicie el tratamiento más tempranos incrementan la probabilidad de un resultado favorable.
|
Tabla de dosificación para el evento cerebrovascular isquémico agudo |
|||
|
Peso (kg) |
Dosis total (mg) |
Dosis en bolo (mg) |
Dosis de Infusión * (mg) |
|
40 |
36.0 |
3.6 |
32.4 |
|
42 |
37.8 |
3.8 |
34.0 |
|
44 |
39.6 |
4.0 |
35.6 |
|
46 |
41.4 |
4.1 |
37.3 |
|
48 |
43.2 |
4.3 |
38.9 |
|
50 |
45.0 |
4.5 |
40.5 |
|
52 |
46.8 |
4.7 |
42.1 |
|
54 |
48.6 |
4.9 |
43.7 |
|
56 |
50.4 |
5.0 |
45.4 |
|
58 |
52.2 |
5.2 |
47.0 |
|
60 |
54.0 |
5.4 |
48.6 |
|
62 |
55.8 |
5.6 |
50.2 |
|
64 |
57.6 |
5.8 |
51.8 |
|
66 |
59.4 |
5.9 |
53.5 |
|
68 |
61.2 |
6.1 |
55.1 |
|
70 |
63.0 |
6.3 |
56.7 |
|
72 |
64.8 |
6.5 |
58.3 |
|
74 |
66.6 |
6.7 |
59.9 |
|
76 |
68.4 |
6.8 |
61.6 |
|
78 |
70.2 |
7.0 |
63.2 |
|
80 |
72.0 |
7.2 |
64.8 |
|
82 |
73.8 |
7.4 |
66.4 |
|
84 |
75.6 |
7.6 |
68.0 |
|
86 |
77.4 |
7.7 |
69.7 |
|
88 |
79.2 |
7.9 |
71.3 |
|
90 |
81.0 |
8.1 |
72.9 |
|
92 |
82.8 |
8.3 |
74.5 |
|
94 |
84.6 |
8.5 |
76.1 |
|
96 |
86.4 |
8.6 |
77.8 |
|
98 |
88.2 |
8.8 |
79.4 |
|
100+ |
90.0 |
9.0 |
81.0 |
Tratamiento coadyuvante:
No se ha estudiado suficientemente la administración concomitante de heparina o inhibidores de la agregación plaquetaria tales como ácido acetilsalicílico durante las primeras 24 horas del inicio de los síntomas. Por tanto, la administración de heparina intravenosa o inhibidores de la agregación plaquetaria tales como ácido acetilsalicílico se debe de evitar durante las primeras 24 horas de tratamiento con Actilyse® debido al mayor riesgo de hemorragia.
Si fuese necesaria la administración de heparina por alguna otra patología (ej. prevención de trombosis venosa profunda) no se debe exceder la dosis de 10 000 UI al día, administrados por vía subcutánea.
Instrucciones de uso:
Bajo condiciones asépticas, el contenido de un frasco ámpula de Actilyse® (50 mg) se disuelve con agua inyectable estéril de acuerdo con la siguiente tabla con la intención de obtener una concentración final de 1 mg de alteplasa por cada 1 mL.
| Polvo seco de Actilyse® | 50 mg |
| Volumen de agua estéril para uso inyectable para agregar al polvo seco | 50 mL |
| Concentración final: | 1 mg alteplasa/mL |
Por tanto, para la reconstitución de la concentración final de 1 mg alteplasa/mL, el volumen total del solvente debe ser transferido al frasco ámpula que contiene la sustancia seca Actilyse®. Para dicho propósito, se incluye una cánula de transferencia en el empaque del producto.
Instrucciones para la reconstitución de Actilyse®
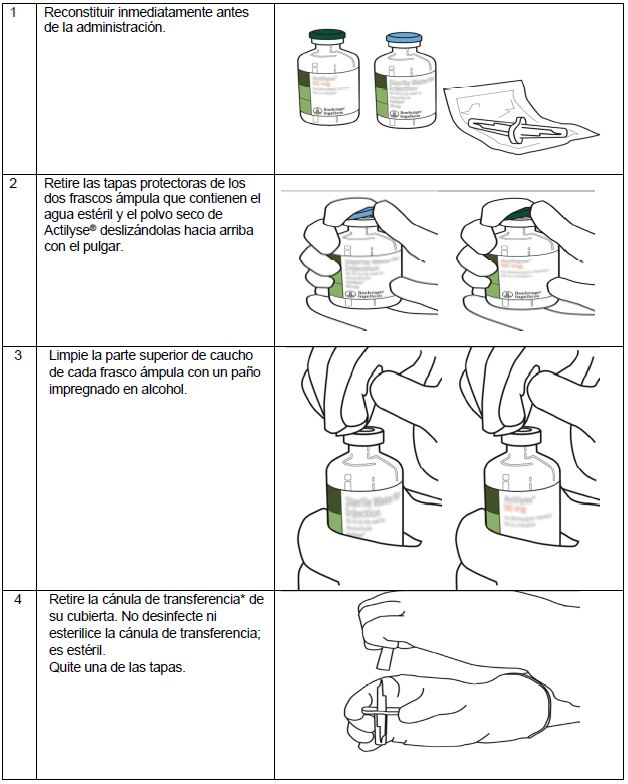
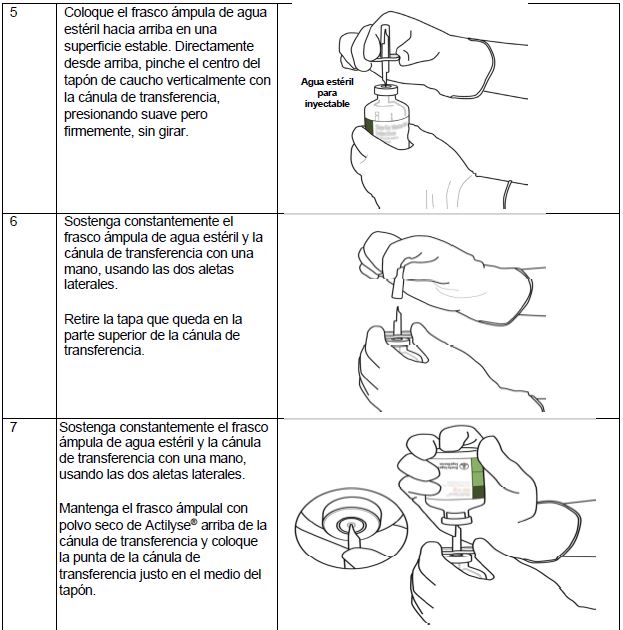
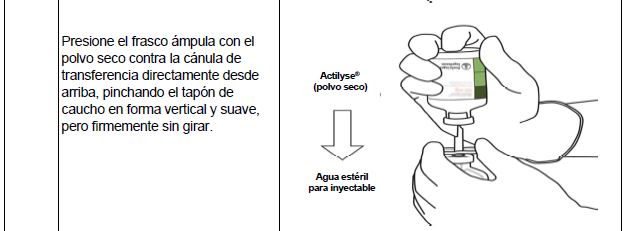
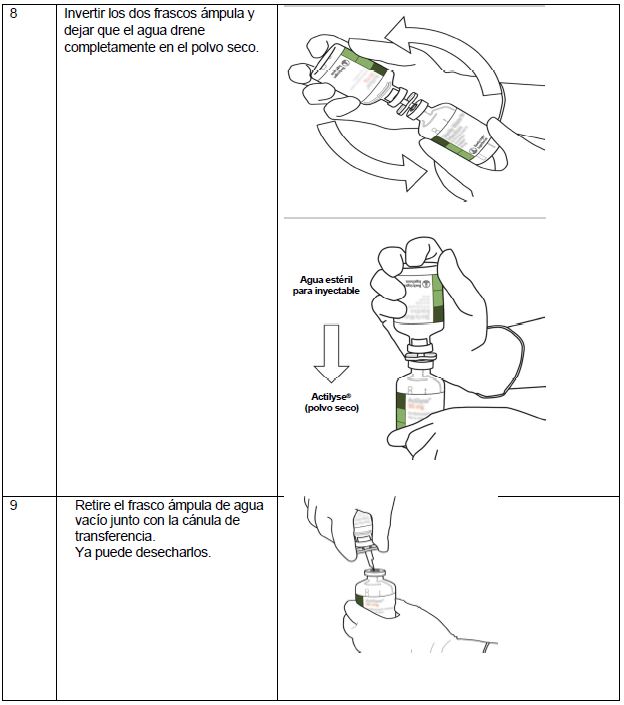

(*Si el kit incluye una cánula de transferencia. La reconstitución también puede realizarse con una jeringa y una aguja).
La solución reconstituida de 1 mg/mL puede diluirse adicionalmente con solución estéril para inyectables de cloruro de sodio de 9 mg/mL (al 0.9 %) hasta una concentración mínima de 0.2 mg/mL dado que no puede descartarse que la solución reconstituida presente turbidez.
No se recomienda una dilución adicional de la solución reconstituida de 1 mg/mL con agua estéril para inyectables ni el uso de soluciones de carbohidratos para infusión en general, p. ej., dextrosa, debido a la creciente formación de turbidez de la solución reconstituida.
Actilyse® no debe mezclarse con otros fármacos, ni en el mismo frasco ámpula para infusión ni en la misma vía intravenosa (ni siquiera con heparina).



